Klinische Prüfung
| HPZenner Clinical Research Organization | CRO | Ärztlicher Direktor: Prof. Dr. med. Zenner | +49-7071-49-645 | |

Arzneimittel

- Durchführungserfahrungen mit Klinischen Studien für Arzneimittel seit 1986.
- Antragstellung BfArM/Ethikkommission, Durchführung, Monitoring, statistische und klinische Auswertung und ICH-konforme Berichtsschreibung von Klinischen Studien bis hin zur Publikation in Fachjournalen
- Studienzentrale in Deutschland für die Organisation stationärer und ambulanter Klinische Prüfungen
- Rechtlich eigenständige Deutsche Study Unit von Prof. Dr. med. Zenner für die ambulante Durchführung von Klinischen Prüfungen
- Unsere Ärzte sind bei Bedarf zertifizierter LKP, Hauptprüfer mit Studienzentrum und zertifizierten Prüfärzten in Tübingen.
- Internationales Netzwerk von LKPs in D, EU, J, Südkorea und USA für die Durchführung multizentrischer Studien
Medizinprodukte
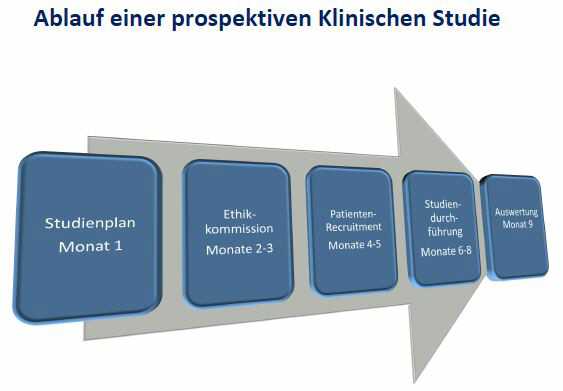
- CRO für die gesamte Studienentwicklung gem. ISO 14155/MPKPV/DIGAV, Antragstellung gem. MDD/MDR/MPG/DIGAV (einschl. BfArM/Ethikkommission), Durchführung, Monitoring, statistische und klinische Auswertung und ICH-konforme Berichtsschreibung von Klinischen Studien von Medizinprodukten bis hin zur Publikation in Fachjournalen
- HPZenner Studienzentrale in Deutschland für die Organisation stationärer und ambulanter Klinische Prüfungen
- Rechtlich eigenständige Deutsche Study Unit von Prof. Dr. med. Zenner für die ambulante Durchführung von Klinischen Prüfungen
- Unsere Ärzte sind bei Bedarf zertifizierter LKP, Hauptprüfer mit Studienzentrum und zertifizierten Prüfärzten in Tübingen.
- Internationales Netzwerk von LKPs in D, EU, J, Südkorea und USA für die Durchführung multizentrischer Studien
Das Spektrum der von uns bewerteten oder geprüften Medizinprodukte ist breit. Hier finden Sie eine Aufstellung...
DiGA
Klinische Prüfungen und Bewertungen von DiGA gehört zu den Spezialthemen von HPZenner. Mehr darüber...
Klinische Bewertung
Sämtliche Medizinprodukte benötigen eine Klinische Bewertung. Unsere Fachärzte führen sie durch. Mehr darüber...



